蛋白质结构在现代微观表征技术下已无所遁形,但要理解其功能,科学家们须应对更高的挑战——研究它的动力学。蛋白质动力学是其发挥活性的重要基础,决定各项生命活动的发生发展,然而目前能给出蛋白质动力学时空信息的实验方法仍很有限。近日,中国工程物理研究院研究生院储祥蔷团队利用先进的中子散射手段,成功从原子分子振动的角度获得蛋白质内部运动发来的讯息。该研究结果以Report形式在线发表在The Innovation。

图1 图文摘要
声子可以存在于蛋白质中吗?
声子是固体物理中用于描述晶格热振动量子化的准粒子,它负责传播材料内部原子振动的能量,可以说是材料内部“声音”的量子态。传统观点认为,声子一般只存在于具有周期性结构的固态晶体中,代表原子间相互作用的动力学性质。作为软物质的生物大分子蛋白质,其自然形态中并不存在晶体,但其内部却含有成千上万个原子。处于自然形态的蛋白质,内部会不会存在类似于原子的晶格振动?能否探测到声子的激发态?如果可以,我们是否可以通过研究声子的性质,进而一窥蛋白质内部动力学的秘密?
中子散射与氘代蛋白质
多年来,科学家们试图采用凝聚态物理中常用的实验手段探索蛋白质中是否存在声子,例如非弹性X射线散射等,但是困难重重。主要原因在于X射线会给蛋白质带来不可逆转的辐照损伤,因而在用X射线测量时,要求照射的时间非常短,一般是秒量级甚至更快,过长的X射线的照射,会引起蛋白质失活。但是研究动力学的非弹性X射线散射的测量时间最少要数小时之久,由此辐照损伤成为了一个无法绕过的大问题。
与X射线相比,中子的能量可以低很多,用来研究蛋白质等生物大分子能够做到完全无损。但中子散射在本研究中需要克服的一个问题是:蛋白质中大量存在的氢元素对于中子有巨大的非相干散射截面。在中子散射过程中,相干散射和非相干散射同时存在。因为声子代表原子的集体运动,只能在相干散射中观测到,所以在我们的实验中,氢元素会给我们的测量带来极大的干扰。这时就需要用到现代中子散射技术应用研究中不可或缺的一门技术——氘代技术。

图2 实验中所用的全氘代绿色荧光蛋白,左图为冻干粉末状态,右图为加入重水的蛋白
氘代蛋白,顾名思义就是将蛋白质中部分或者所有的氢原子替换成它的同位素氘(D)。这样就能有效避开氢元素带来的非相干散射背景的强烈干扰,得到样品中的相干散射信息。本研究中所用的样品是由美国橡树岭国家实验室制备的全氘代绿色荧光蛋白(图2)。 中子散射数据是在美国散裂中子源SNS的非弹性散射谱仪SEQUOIA上收集的(图3)。
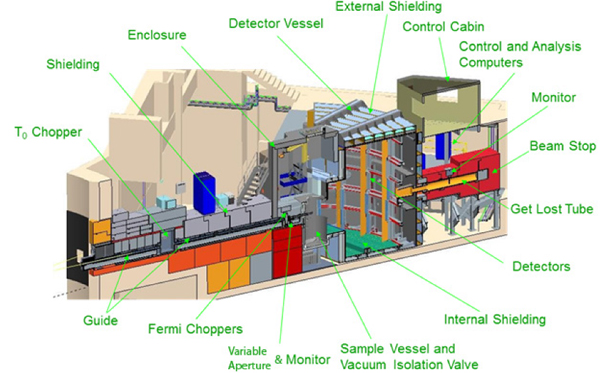

图3 美国散裂中子源SNS上的飞行时间中子散射谱仪SEQUOIA (上图)及其探测器阵列(下图)。
图片来源:https://neutrons.ornl.gov/sequoia
如何在不同的时间尺度上理解蛋白质动力学?
目前研究蛋白质动力学的手段很多,包括实验和计算,能够达到毫秒、微秒,甚至到纳秒或皮秒的时间尺度。但是在小于皮秒或更短的时间尺度上的动力学是什么样的,此前并没有实验可以直接观察到。在本研究中,结合非弹性中子散射与氘代蛋白技术,直接观察到了蛋白质中存在类声子的激发,根据其能量可以推算它的动力学时间尺度在皮秒至飞秒量级。
在蛋白质动力学研究中,温度是最关键的变量之一。通过分析声子的色散关系随温度的变化,即研究声子能量(2~10 meV)与动量(0.5~3 ?-1)的关系,就可以得到蛋白质的内部运动在皮秒甚至飞秒量级的动力学信息。SNS的超高峰值流强使得我们可以在实验中测得蛋白质中从零下一百多度(150 K)到摄氏零度(273 K)之间十几个温度下的声子色散关系。从声子的性质可以进一步推理出描绘蛋白质动力学的能量景观(energy landscape)如图4所示呈多层级结构,并将它与蛋白质的生物活性及功能联系起来。
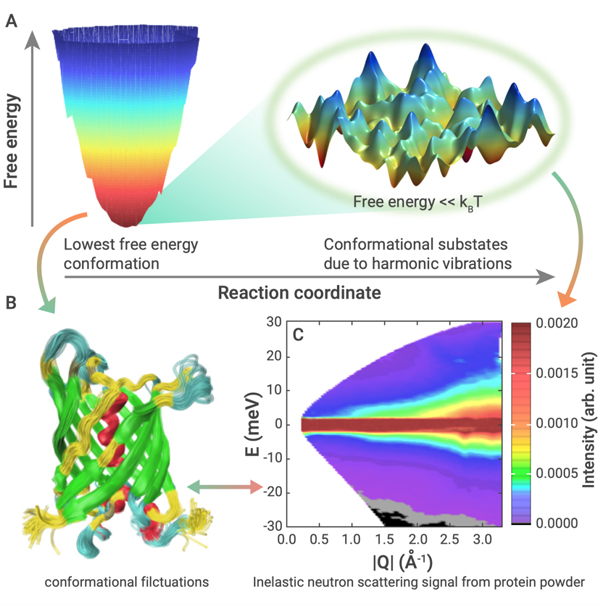
图4 描述蛋白质动力学的能量景观具有多层级结构
全文详见:https://www.cell.com/the-innovation/fulltext/S2666-6758(21)00124-7








